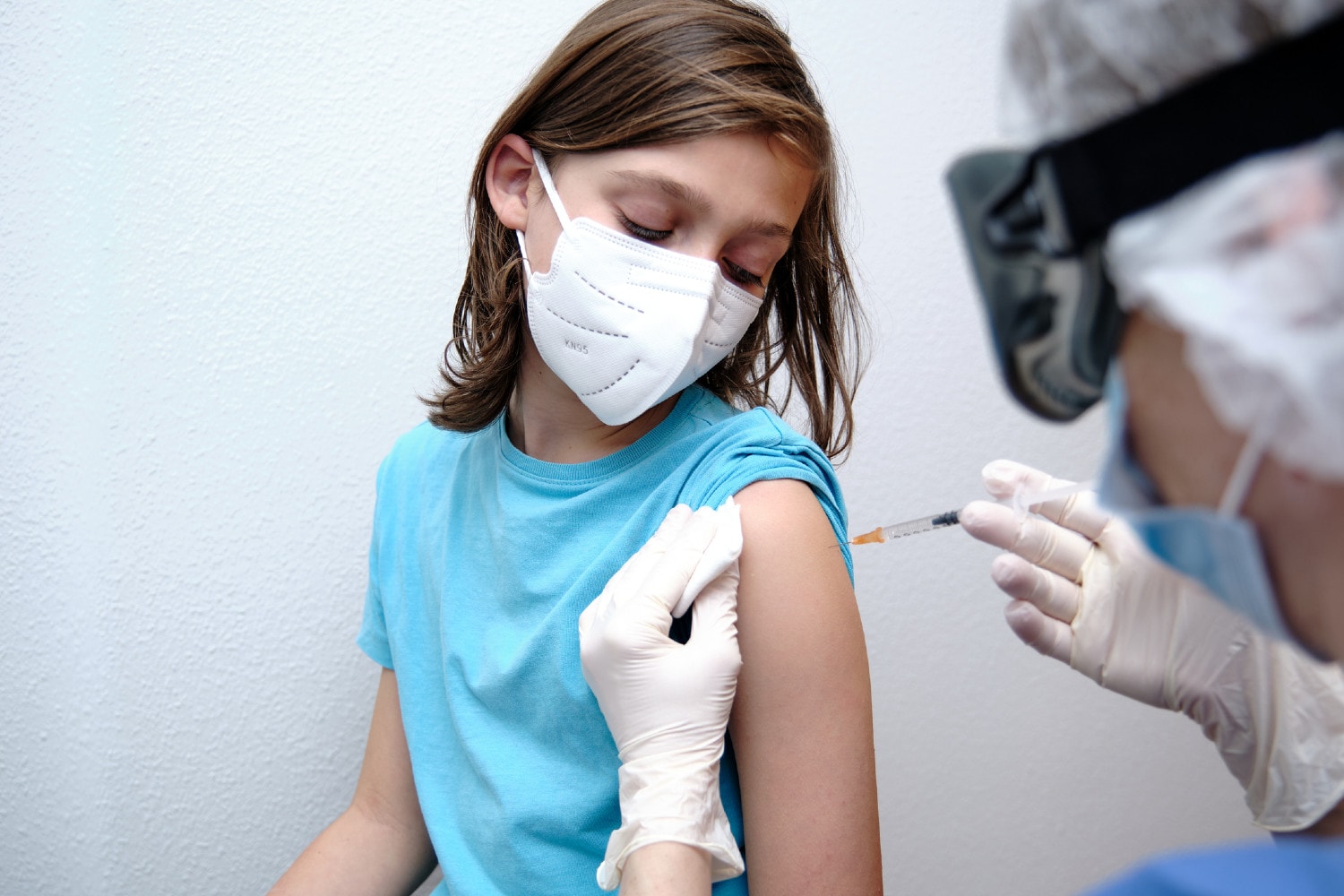
Przed wydaniem zezwolenia na stosowanie https://www.focus.pl/artykul/cdc-sprawdzilo-skutecznosc-szczepionek-mrna-na-medykachu młodszych nastolatków, FDA przeanalizowała dane z badań klinicznych III fazy przesłane przez firmę Pfizer. Pod koniec marca producent szczepionki informował, że badanie z udziałem 2260 dzieci w wieku od 12 do 15 lat wykazało 100 procent skuteczności szczepionki i udowodniło, że jest ona dobrze tolerowana przez młodych pacjentów.
Połowa uczestników badania otrzymała szczepionkę Comirnaty, a druga połowa – placebo. W pierwszej grupie nie odnotowano żadnych przypadków COVID-19, a w drugiej zaobserwowano 18 przypadków zakażenia. Działania niepożądane w badanej grupie wiekowej były zgodne z tymi zgłaszanymi w starszych grupach. Najczęstszymi działaniami niepożądanymi były: ból w miejscu wstrzyknięcia, zmęczenie, https://www.focus.pl/artykul/jak-radzic-sobie-z-bolem-glowy-trzy-rady-od-ekspertki-neurobiologii, dreszcze, bóle mięśni, gorączka i bóle stawów.
Zezwolono na szczepienia przeciw COVID-19 w grupie 12-15 lat
Amerykańska agencja wzięła też pod uwagę dane dotyczące poszczepiennej odpowiedzi immunologicznej niektórych zaszczepionych dzieci i porównała je z reakcjami starszych nastolatków i dorosłych, którym podano tę samą szczepionkę. – Reakcja na szczepionkę była doskonała, a w rzeczywistości nawet lepsza w młodszej grupie wiekowej niż w grupie 16-25 lat – mówi dr Peter Marks, dyrektor Centrum Oceny i Badań Biologicznych FDA.
FDA orzekła, że „znane i potencjalne korzyści” szczepionki Comirnaty dla grupy wiekowej 12-15 lat przewyższają „znane i potencjalne ryzyko” – podano w oficjalnym komunikacie. Preparat Pfizera będzie podawany nastolatkom w dwóch dawkach w odstępie trzech tygodni, w takiej samej dawce, jaką zatwierdzono dla starszych grup wiekowych.
CDC musi wydać decyzję w sprawie szczepionki
Wydanie zarządzenia przez FDA nie oznacza jeszcze, że każdy 12-latek może zgłosić się na szczepienie. Teraz wyniki badań klinicznych oraz zalecenia FDA musi przeanalizować kolejny organ ds. ochrony zdrowia, czyli Centrum ds. Kontroli i Zapobiegania Chorobom (CDC, Centers for Disease Control and Prevention).
Komitet doradczy ds. praktyk szczepiennych przy CDC ma spotkać się w środę (12 maja), aby ustalić czy agencja powinna wydać zalecenie do stosowania szczepionki w nowej, młodszej grupie. Następnie dyrektor CDC, dr Rochelle Walensky, zapozna się ze stanowiskiem komitetu i dopiero wówczas podejmie ostateczną decyzję. Szczepienia dla nastolatków w wieku od 12 do 15 lat rozpoczną się dopiero po uzyskaniu pozytywnych zaleceń CDC.
Młodzi ludzie też będą potrzebowali szczepionki na COVID-19
Choć wśród nastolatków ryzyko ciężkiego przebiegu COVID-19 jest niewielkie, to zaszczepienie tej części populacji jest kluczowe dla bezpieczeństwa całej społeczności – podkreśla FDA. Z oficjalnych danych amerykańskiej agencji wynika, że od 1 marca do 30 kwietnia w grupie wiekowej 11-17 lat odnotowano 1,5 miliona przypadków COVID-19. Zezwolenie na szczepienia kolejnej grupy wiekowej sprawia, że obecnie do szczepień kwalifikuje się już 85 proc. mieszkańców Stanów Zjednoczonych.
W zeszłym tygodniu Pfizer podał, że spodziewa się, że we wrześniu uzyska pozwolenie na stosowanie szczepionki Comirnaty dla dzieci w wieku od 2 do 11 lat. Obecnie trwają badania w tej grupie wiekowej, dodatkowo rozszerzone o grupę dzieci powyżej 6. miesiąca życia.
Źródło: FDA