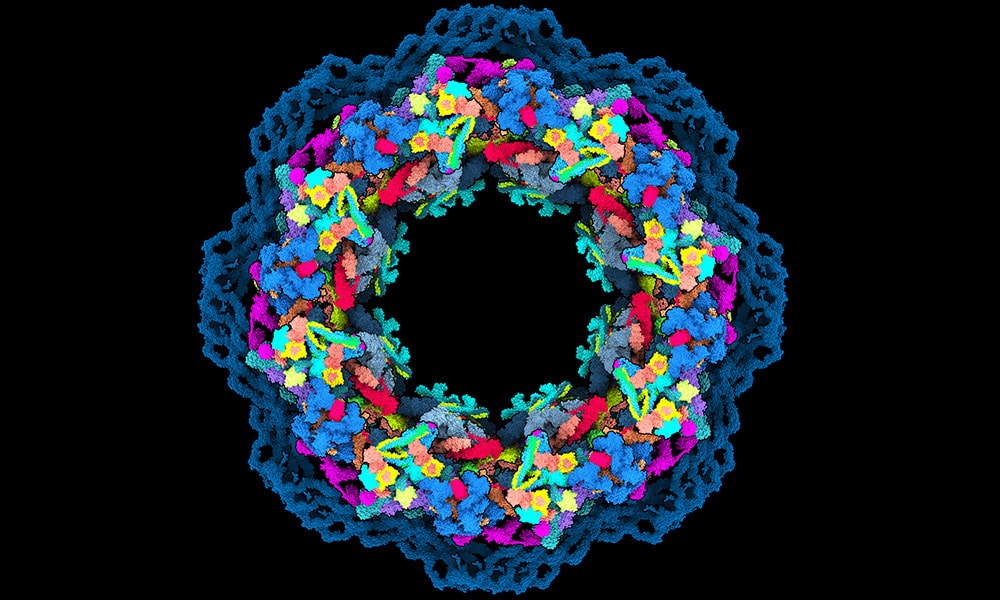
Mianem porów jądrowych określamy otwory w podwójnej błonie jądrowej, służące do transportu cząsteczek z jądra komórkowego do cytoplazmy i w kierunku przeciwnym. Por jądrowy tworzy tzw. jądrowy kompleks porowy (NCP), czyli struktura o średnicy 120-150 nm. Im więcej NCP, tym komórka bardziej aktywna – jest ona zależna od wieku, metabolizmu i typu komórki.
NCP od dawna stanowi zagadkę dla naukowców. Teraz, dzięki połączeniu technik eksperymentalnych i AlphaFold2 udało się odkryć jego architekturę. Szczegóły opisano w czasopiśmie Science.
Bramy do komórek
NCP to prawdziwy gigant molekularny, który znajduje się w błonie oddzielającej jądro od cytoplazmy. Ma kształt pączka i jest swoistą “bramą”, punktem kontrolnym dla cząsteczek, które przemieszczają się między cytoplazmą a jądrem. Bez NCP podstawowe procesy zachodzące w komórce (ekspresja genów i translacja) nie byłyby możliwe. Transport jądrowy jest także ważny dla przebiegu wielu chorób, m.in. neurodegeneracyjnych i nowotworowych.
Ale jak tak właściwie jest zbudowany NCP, w jaki sposób białka w nim są ze sobą sklejone? W jaki sposób przyczepia się do błony jądrowej? Na te i inne pytania udało się odpowiedzieć Grupie Kosińskiego z EMBL Hamburg i Centrum Biologii Systemów Strukturalnych (CSSB), Laboratoriom Becka i Hummera z Instytutu Biofizyki Maksa Plancka. Stworzyli oni najbardziej kompletny jak dotąd model ludzkiego NCP, łącząc program do przewidywania struktury białek AlphaFold2 z takimi technikami, jak tomografia kriogeniczna.

NCP to prawdziwa trójwymiarowa układanka, zawierająca ok. 30 różnych białek, z których każde występuje w wielu kopiach. Nawet 1000 elementów układanki tworzy okrągły rdzeń z otaczającymi go elastycznymi fragmentami. Do tej pory najdokładniejsze modele rdzenia NCP obejmowały jedynie 46% jego struktury, ale teraz udało się zwiększyć tę wartość do 90%. Poprzednie modele zawierały sporo luk, ale najnowszy jest wyjątkowo dokładny.
Jan Kosiński, kierownik grupy EMBL, mówi:
To tak jak z demontażem i ponownym montażem urządzenia elektronicznego – zawsze zostają jakieś śrubki i nie wiadomo, gdzie powinny być. W końcu udało nam się dopasować większość z nich i teraz wiemy dokładnie, gdzie są, co robią i w jaki sposób.
Naukowcom udało się dokonać wizualizacji NCP w różnych skalach i na różnych poziomach szczegółowości. Więcej szczegółów dotyczących poszczególnych białek ujawnił program AlphaFold2 stworzony przez firmę DeepMind.
AlphaFold2 był dla nas przełomowym momentem. Wcześniej nie znaliśmy struktury wielu białek wchodzących w skład NPC. Nie można ułożyć puzzli, nie wiedząc, jak wyglądają poszczególne elementy. Ale AlphaFold2 w połączeniu z innymi metodami pozwolił nam przewidzieć te kształty.
Agnieszka Obarska-Kosińska, doktorantka, która przeprowadziła modelowanie molekularne
Uzyskany model był tak kompletny, że umożliwił badaczom stworzenie symulacji molekularnych w czasie, które wyjaśniają, w jaki sposób białka NCP i błona jądrowa oddziałują ze sobą, tworząc stabilny por i jak reaguje on na bodźce mechaniczne.
Grupa Kosińskiego będzie w przyszłości pracować nad rozwojem automatycznych metod integracji danych strukturalnych i mikroskopowych przy użyciu AlphaFold2 i oprogramowania Assembline. Planują oni zastosować te metody do badania procesów molekularnych napędzających infekcje wirusowe.