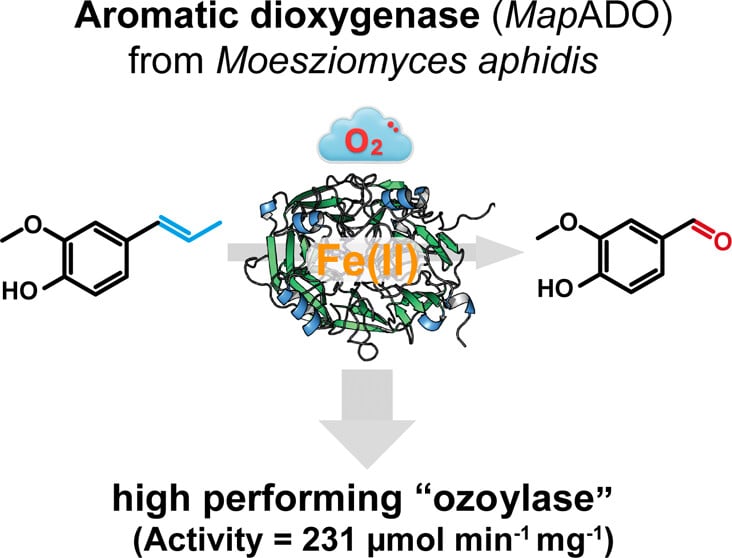
W centrum odkrycia znalazł się niepozorny grzyb Moesziomyces aphidis, z którego wyizolowano enzym MapADO – nowego przedstawiciela dioksygenaz aromatycznych. Jak wykazali polscy naukowcy, MapADO ma unikalną zdolność selektywnego rozszczepiania wiązań podwójnych C=C w związkach aromatycznych. To reakcja kluczowa w syntezie chemicznej, zwykle przeprowadzana przy użyciu ozonu – silnie utleniającego i toksycznego gazu, którego stosowanie wiąże się z wysokim ryzykiem operacyjnym. Enzym opracowany przez badaczy z Krakowa okazuje się znacznie bezpieczniejszą i bardziej ekologiczną alternatywą dla tej tradycyjnej metody.
Czytaj też: Synteza niemożliwego wreszcie się udała. Ten izotop istnieje na krawędzi rozpadu materii
Odkrycia dokonali dr inż. Jacek Plewka (pierwszy współautor publikacji) oraz dr inż. Katarzyna Magiera-Mularz z Wydziału Chemii UJ, którzy – we współpracy z zespołami z Austrii i Tajlandii – przeprowadzili kompleksowe badania strukturalne i funkcjonalne enzymu. Wyniki ich pracy ukazały się w czasopiśmie JACS Au.
Enzym zamiast ozonu
Ozonoliza – czyli rozszczepienie wiązań podwójnych za pomocą ozonu – to technika znana od dziesięcioleci, szeroko stosowana w przemyśle chemicznym, ale obciążona znacznym ryzykiem środowiskowym. Ozon to nie tylko silny utleniacz, ale też gaz, którego nie da się przechowywać – musi być wytwarzany na miejscu, a jego użycie wiąże się z ryzykiem wybuchów i powstawania toksycznych produktów ubocznych.
MapADO, jako enzym, eliminuje te problemy. Działa selektywnie i skutecznie, nie wymagając ani wysokich temperatur, ani agresywnych reagentów. W warunkach laboratoryjnych sprawdził się m.in. w przekształcaniu izoeugenolu – naturalnego związku aromatycznego – do waniliny, która znajduje zastosowanie w przemyśle spożywczym, kosmetycznym i farmaceutycznym. To nie tylko udana demonstracja działania enzymu, ale i dowód na to, że enzymatyczna alternatywa może być równie efektywna co klasyczne metody chemiczne – a przy tym znacznie bardziej przyjazna środowisku.
Dzięki badaniom z wykorzystaniem krystalografii rentgenowskiej oraz analiz biofizycznych i biochemicznych udało się dokładnie zrozumieć, jak MapADO działa. Enzym zbudowany jest w formie siedmiopłatowego β-propelleru, a jego centrum aktywne zawiera jon Fe2+ – żelazo, które jest kluczowe dla procesu utleniania. Cztery reszty histydynowe stabilizują centrum katalityczne, umożliwiając efektywne wiązanie substratu.
Szczególną rolę odgrywają reszty Y136 i K169 – to one odpowiedzialne są za precyzyjne ułożenie substratu względem cząsteczki tlenu, co umożliwia skuteczne rozszczepienie wiązania C=C. Co więcej, enzym wykazuje odporność na wysokie stężenia substratów i ma dużą tolerancję pH, co czyni go wyjątkowo atrakcyjnym kandydatem do wdrożeń przemysłowych.
Choć MapADO wciąż znajduje się na etapie badań laboratoryjnych, jego potencjał komercyjny jest ogromny. Branże, które szczególnie mogą skorzystać z jego właściwości, to przemysł chemiczny, kosmetyczny, spożywczy i farmaceutyczny. Co najważniejsze, zastosowanie enzymu wpisuje się w założenia zielonej chemii – nurtu, który zakłada redukcję toksycznych odpadów, zwiększenie bezpieczeństwa operacji chemicznych oraz minimalizację zużycia energii.
W erze zmian klimatycznych i przemian technologicznych przemysł potrzebuje właśnie takich rozwiązań – opartych na biologii, efektywnych i bezpiecznych. Praca badaczy z UJ pokazuje, że nauka może dostarczyć odpowiedzi na najbardziej palące wyzwania współczesności, nie tylko w zakresie innowacji, ale i etyki odpowiedzialnej produkcji.